
Гидролиз молочного сырья протеолитическими ферментами для выделения отдельных белковых фракций
Ферменты и ферментные препараты в КАТАЛОГЕ на MilkLife.ru
Ассортимент выпускаемой молокоперерабатывающими предприятиями Республики Беларусь продукции включает более 1800 наименований. Однако предполагается дальнейшее увеличение производства молока, что будет способствовать наращиванию количества и номенклатуры производимой продукции. Так, перспективным направлением развития отрасли считается углубление переработки сырья, позволяющее выделять либо модифицировать отдельные компоненты.
ГИДРОЛИЗ БЕЛКОВЫХ КОМПОНЕНТОВ В МОЛОЧНОЙ ПРОМЫШЛЕННОСТИ
Гидролиз является одним из способов изменения белкового состава молочного сырья. Следует отметить, что производители пищевых продуктов и ингредиентов отдают предпочтение ферментативному гидролизу ввиду наличия широкого спектра препаратов, которые считаются безопасными и естественными. Наиболее изученными и используемыми ферментами для производства гидролизатов молочного белка являются ферменты животного происхождения трипсин, пепсин и химотрипсин, растительные ферменты, в основном папаин и бромелайн, бактериальные протеазы, в основном происходящие от Bacillus licheniformis и Bacillus subtilis. Ферментативный гидролиз белков в молочной отрасли может использоваться для решения следующих задач: снижения аллергенного потенциала, получения биологически активных пептидов, селективной обработки с целью выделения отдельных видов молочных белков.
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ГИДРОЛИЗА БЕЛКА И ИХ СВОЙСТВА
При проведении анализа представленных на рынке ферментов для протеолического гидролиза молочного сырья для дальнейших исследований в области селективного гидролиза белков предварительно отобраны следующие виды: пепсин, трипсин и химотрипсин.
Подбор ферментных препаратов для выделения отдельных видов молочных белков путем селективного гидролиза на основе исследования механизма действия на молочное сырье химотрипсина, трипсина и пепсина.
ГИДРОЛИЗ МОЛОЧНОГО СЫРЬЯ ХИМОТРИПСИНОМ, ТРИПСИНОМ И ПЕПСИНОМ
Методология исследований заключается в анализе и систематизации научно-технической информации, представленной в трудах отечественных и зарубежных ученых, информационных ресурсах интернет-источников в области переработки молочного сырья.
Для проведения процесса гидролиза использовали следующие ферментные препараты:
-
химотрипсин (код ATX: D03BA, производитель: ООО «Самсон-Мед»);
-
трипсин (код ATX: D03BA, производитель: ООО «Самсон-Мед»);
-
пепсин 1:10000 (CAS Number 9001-75-6, производитель Chem-Impex International).
В качестве молочного сырья использовали концентрат сывороточный белковый КСБ (производитель – Щучинский филиал ОАО «Молочный мир»), с массовой долей белка 81,8%. Восстановление концентрата сывороточного белкового проводили в следующем соотношении: 5 г сухого продукта на 95 г воды.
Гидролиз молочного сырья проводили с использованием мешалки магнитной с подогревом RCT basic (IKA), в комплектацию которой входит датчик PT 1000.60 из нержавеющей стали, позволяющий контролировать температурные параметры протекания процесса гидролиза.
Оптимальные условия проведения гидролиза (рН, температура) подобраны в соответствии с задачей по выделению отдельных видов белков молочного сырья на основе анализа литературных источников, в которых содержатся сведения о возможных режимах гидролиза молочного сырья указанными выше ферментными препаратами. Количество вносимого фермента было подобрано в рамках исследований, проведенных ранее.
Идентификацию белковых фракций по результатам гидролиза молочного сырья осуществляли методом денатурирующего электрофореза в полиакриламидном геле (12%) с добавлением додецилсульфата натрия.
В лабораторных условиях проводили гидролиз восстановленного концентрата сывороточного белкового химотрипсином, трипсином и пепсином.
ГИДРОЛИЗ СЫВОРОТОЧНЫХ БЕЛКОВ МОЛОКА ХИМОТРИПСИНОМ
В рамках проведенных предварительных исследований проверяли возможность ферментации восстанновленного конценрата сывороточного белкового химотрипсином в концентрациях 0,01%, 0,02% и 0,1%. Для дальнейших исследований была подобрана концентрация 0,1%, что соовтетствует соотношению фермент/субстрат 2,46%.
Условия проведения гидролиза химотрисином:
-
температура 25°С;
-
активная кислотность ферментируемой системы 8,5 ед. рН (доводили рН до необходимого значения путем добавления раствора NaOH);
-
продолжительность 100 минут.
Инактивацию фермента проводили термической обработкой при температуре 65°C в течение 10 минут. Результаты идентификации белкового состава отобранных проб ферментируемой системы (20, 40, 60, 80 и 100 минут) представлены на электрофореграмме на рисунке 1.
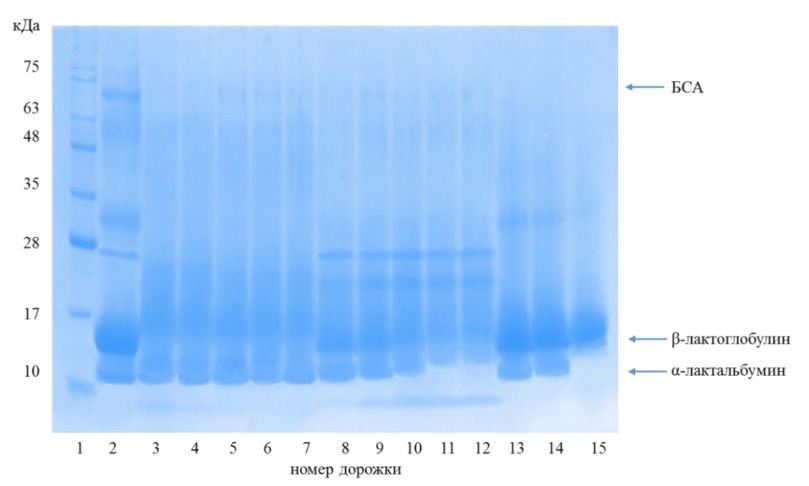
Рисунок 1 – Результаты ДСН-электрофореза гидролиза образцов восстановленного концентрата сывороточного белкового химотрипсином, трипсином, пепсином
Примечание: 1 – маркер молекулярных масс, 2 – контроль; 3 – 0,1% химотрипсина, 20 минут; 4 – 0,1% химотрипсина, 40 минут; 5 – 0,1% химотрипсина, 60 минут; 6 – 0,1% химотрипсина, 80 минут; 7 – 0,1% химотрипсина, 100 минут; 8 – 0,1% трипсина, 20 минут; 9 – 0,1% трипсина, 40 минут; 10 – 0,1% трипсина, 60 минут; 11 – 0,1% трипсина, 80 минут; 12 – 0,1% трипсина, 100 минут; 13 – 0,005% пепсина, 20 минут; 14 – 0,005% пепсина, 40 минут, 15 – 0,005% пепсина, 60 минут. Источник данных: получен авторами на основании результатов экспериментальных исследований.
Анализ полос с №3 по № 7 на электрофореграмме свидетельствует о том, что в процессе ферментации химотрипсином восстановленного концентрата сывороточного белкового в заданных условиях рН и температуры наблюдается гидролиз β-лактоглобулина и альбумина сыворотки крови (БСА), в незначительной степени наблюдается гидролиз α-лактульбумина.
ГИДРОЛИЗ СЫВОРОТОЧНЫХ БЕЛКОВ МОЛОКА ТРИПСИНОМ
Процесс гидролиза восстановленного концентрата сывороточного белкового трипсином предварительно проводили используя следующие концентрации фермента: 0,01%, 0,02%, 0,1%. Для дальнейших исследований была определена концентрация трипсина 0,1% (соотношение фермент/субстрат 2,46%).
Условия проведения гидролиза трипсином:
-
температура 42°С;
-
активная кислотность ферментируемой системы 7,7 ед. рН (доводили рН до необходимого значения путем добавления раствора NaOH);
-
продолжительность 100 минут.
Инактивацию фермента проводили термической обработкой при 70°C в течение 30 минут. Через 20, 40, 60, 80 и 100 минут процесса были отобраны пробы ферментируемой системы, результаты идентификации белкового состава которых представлены на электрофореграмме на рисунке 1.
Анализ полос с №8 по №12 на электрофореграмме (рисунок 1) свидетельствует о том, что в процессе ферментации трипсином в заданных условиях рН и температуры наблюдается гидролиз α-лактальбумина, β-лактоглобулина и альбумина сыворотки крови (БСА), при этом селективного действия по отношению к какому-либо виду белка молочного сырья исследуемый фермент не проявляет. Следует отметить наличие по сравнению с дорожкой контроля на дорожках 8-12 новой полосы, которая располагается в интервале значений молекулярной массы от 17 до 28 кДа и может быть характерной для самого фермента трипсина, имеющего молекулярную массу около 24 кДа.
ГИДРОЛИХ СЫВОРОТОЧНЫХ БЕЛКОВ МОЛОКА ПЕПСИНОМ
В рамках предварительных исследований вносили пепсин в ферментируемую систему в следующих концентрациях: 0,005%, 0,01%, 0,02%. Так, концентрация 0,005% была выбрана для дальнейших экспериментов в связи с необходимость рационального внесения ферментных препаратов. Соотношение фермент/белковый субстрат, исходя из количества вносимого пепсина, составляет 0,125%.
Условия проведения гидролиза пепсином:
-
температура 40°С;
-
активная кислотность ферментируемой системы 2 ед. рН (доводили рН до необходимого значения путем добавления раствора HCl);
-
продолжительность 60 минут.
Инактивацию фермента проводили термической обработкой при температуре 85°C в течение 15 минут.
В процессе гидролиза отобраны три пробы ферментируемой системы: через 20, 40 и 60 минут. Результаты идентификации белкового состава отобранных проб представлены на электрофореграмме на рисунке 1.
ОСОБЕННОСТИ ГИДРОЛИЗА РАЗЛИЧНЫХ СЫВОРОТОЧНЫХ БЕЛКОВ МОЛОКА
На основе проведенного анализа дорожек от № 13 до № 15 электрофореграммы следует отметить, что гидролиз α-лактальбумина и альбумина сыворотки крови (БСА) начинается уже через 20 минут после внесения фермента, а полный гидролиз указанных фракций наблюдается через 60 минут. Одновременно с тем, β-лактоглобулин проявляет устойчивость к действию пепсина при описанных условиях проведения исследований не зависимо от продолжительности воздействия.
Согласно информации, представленной в ранних исследованиях четвертичная структура β-лактоглобулина зависит от pH среды следующим образом:
-
от 5,2 до 8 ед. рН при комнатной температуре димер;
-
от 3,5 до 5,2 ед. рН образует октамер с молекулярной массой около 140000 кДа;
-
выше 8,0 ед. рН и ниже 3,0 ед. рН – диссоциирует на мономеры.
В связи с тем, что представленные выше исследования проводилось при значении активной кислотности 2 ед. рН, β-лактоглобулин при воздействии пепсина находился в форме мономера.
СЕЛЕКТИВНЫЙ ГИДРОЛИЗ ФРАКЦИЙ СЫВОРОТОЧНЫХ БЕЛКОВ МОЛОКА И ВЫДЕЛЕНИХ ИХ ИЗ МОЛОЧНОГО СЫРЬЯ
В рамках подбора препаратов, для выделения отдельных видов молочных белков путем селективного гидролиза, в лабораторных условиях проведены исследования по определению механизма действия на восстановленный концентрат сывороточный белковый следующих протеолитических ферментов: химотрипсина, трипсина и пепсина.
Установлено, что под действием химотрипсина в ферментируемой системе при активной кислотности 8,5 ед. рН, температуре 25°С наблюдается гидролиз β-лактоглобулина и альбумина сыворотки крови (БСА), в незначительной степени – α-лактульбумина. Определено, что трипсин не обладает специфичным действием к какому-либо белку восстановленного концентрата сывороточного белкового при рН равном 7,7, темпеатуре 42°С, в связи с тем, что происходит расщепление всех белков. Исследования показали, что под действием пепсина при активной кислотности 2 ед. рН, температуре 40°С в процессе гидролиза просиходит расщепление α-лактальбумина и альбумина сыворотки крови, в то время как β-лактоглобулин проявляет устойчивость к действию фермента.
Таким образом, для селективного гидролиза молочного белка при условиях проведения процесса, согласно представленным выше параметрам, могут быть использованы следующие ферментные препараты:
-
для выделения α-лактальбумина – химотрипсин;
-
для выделения β-лактоглобулина – пепсин.
Применение трипсина для селективного гидролиза молочного сырья не является целесообразным при описанных условиях проведения гидролиза.
Результаты данного исследования будут использованы в дальнейшем для решения задачи по изменению фракционного состава белков молочного сырья в ходе комбинирования ферментативных и мембранных технологических процессов.
Источник: Журнал «Актуальные вопросы переработки мясного и молочного сырья». – 2023. – №. 16. – С. 68-73.










